· Felipe Vengoechea · biologia-fungi
Esporas: Guía Completa de Reproducción y Supervivencia Fúngica
Análisis exhaustivo de esporas fúngicas: tipos (basidiosporas, ascosporas, conidiosporas), formación, dispersión, germinación, resistencia extrema, aplicaciones en cultivo/micología, y rol ecológico. Guía fundamental para entender reproducción de hongos.
Las esporas son las unidades microscópicas de vida que permiten a los hongos conquistar prácticamente cada rincón del planeta. Un solo champiñón maduro puede liberar 16 mil millones de esporas en 48 horas. Invisibles a simple vista pero omnipresentes en el aire que respiramos (~1,000-10,000 esporas/m³ aire exterior), estas estructuras microscópicas combinan resistencia extrema (sobreviven vacío espacial, radiación, -200°C) con potencial reproductivo masivo.
Esta guía exhaustiva cubre la biología de las esporas fúngicas: tipos (basidiosporas, ascosporas, conidiosporas), formación, mecanismos de liberación asombrosos, germinación, aplicaciones en cultivo/identificación, y su rol ecológico crítico.
¿Qué son las esporas fúngicas?
Definición y función
Espora (del griego spora = semilla):
Célula reproductiva haploide (n cromosomas) o diploide (2n cromosomas) producida por hongos, capaz de:
- Resistir condiciones adversas por períodos prolongados (años a siglos)
- Dispersarse a largas distancias (viento, agua, animales)
- Germinar y formar nuevo micelio cuando condiciones son favorables
Diferencia clave con semillas:
- Semillas (plantas): Contienen embrión + reservas nutritivas, multicelulares
- Esporas (hongos): Generalmente unicelulares, mínimas reservas, extremadamente ligeras
Tamaño y abundancia
Dimensiones típicas:
- Pequeñas: 2-5 µm (micrómetros) - ej. Aspergillus
- Medianas: 5-15 µm - mayoría hongos comestibles
- Grandes: 15-50 µm - ej. Coprinus, Podaxis
Producción masiva:
- Champiñón (Agaricus bisporus): 16 mil millones esporas/basidiocarpo
- Puffball gigante (Calvatia gigantea): 7 trillones esporas/cuerpo fructífero
- Un solo hongo libera más esporas que humanos existen en la Tierra
Concentración ambiental:
- Aire exterior: 1,000-10,000 esporas/m³
- Aire interior: 100-1,000 esporas/m³
- Implicación: Inhalamos ~10,000-100,000 esporas fúngicas/día (mayoría inofensivas)
Tipos de esporas en hongos
Clasificación por origen (sexual vs asexual)
1. Esporas sexuales (meiosporas)
Formación: Tras fusión nuclear (cariogamia) + meiosis
Resultado: Esporas haploides (n), genéticamente únicas
Función: Diversidad genética → adaptación, evolución
Tipos principales:
| Tipo | División | Estructura | Ejemplos |
|---|---|---|---|
| Basidiosporas | Basidiomycota | Formadas externamente en basidio (4 esporas típicamente) | Champiñón, shiitake, reishi, pleurotus |
| Ascosporas | Ascomycota | Formadas internamente en asco (8 esporas típicamente) | Trufas, morillas, levadura cerveza |
| Zigosporas | Zygomycota | Espora resistente de pared gruesa | Rhizopus (moho pan negro) |
| Oosporas | Oomycota† | Espora sexual de pared gruesa | Phytophthora (no verdaderos hongos) |
†Oomycota técnicamente no son hongos (reino Chromista), pero históricamente estudiados en micología
2. Esporas asexuales (mitosporas)
Formación: Mitosis simple (sin fusión nuclear/meiosis)
Resultado: Clones genéticamente idénticos al parental
Función: Colonización rápida de ambientes favorables
Tipos principales:
| Tipo | Formación | Características | Ejemplos |
|---|---|---|---|
| Conidiosporas (conidios) | Extremo de hifas especializadas (conidióforos) | Más común en ascomycetes | Penicillium, Aspergillus, Trichoderma |
| Esporangiosporas | Dentro de esporangio (saco) | Común en zygomycetes | Rhizopus, Mucor |
| Artroesporas | Fragmentación de hifas | Cadenas de células rectangulares | Coccidioides (patógeno) |
| Blastosporas | Gemación (budding) | Común en levaduras | Saccharomyces, Candida |
| Clamidosporas | Hifas engrosadas, pared doble | Resistencia extrema | Fusarium, Candida albicans |
Clasificación por morfología
Forma:
- Esférica (más común)
- Elipsoidal/ovalada
- Cilíndrica
- Fusiforme (forma huso)
- Estrellada (Geastrum)
Superficie:
- Lisa
- Verrugosa (pequeñas protuberancias)
- Espinosa/equinulada
- Reticulada (patrón red)
Color:
- Transparente/hialina
- Blanco
- Amarillo, rosa, marrón, negro, verde
- Huella esporada: Color en masa (clave identificación hongos)
Septación:
- No-septada (unicelular)
- 1-septada (2 células)
- Multi-septada
Formación de esporas (esporulación)
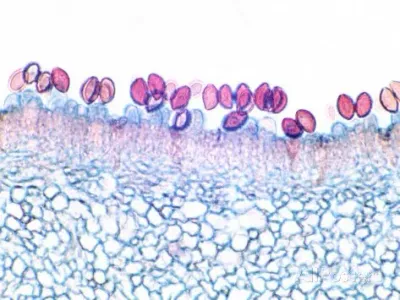
Basidiosporas: mecanismo más estudiado
Estructura: Basidio
El basidio es la célula especializada donde se forman basidiosporas en Basidiomycota.
Proceso paso a paso:
Plasmogamia (fusión células):
- Dos hifas monocarióticas compatibles (n+n) se fusionan
- Forman hifa dicariótica (núcleos separados, no fusionados aún)
Formación de basidio:
- Hifa dicariótica forma célula terminal hinchada (basidio joven)
Cariogamia (fusión nuclear):
- Dos núcleos en basidio se fusionan → célula diploide (2n)
Meiosis:
- Basidio diploide sufre meiosis → 4 núcleos haploides (n)
Esterigmatos:
- Basidio proyecta 4 pequeñas protuberancias (esterigmatos)
Migración nuclear:
- Cada núcleo haploide migra a un esterigma
Formación esporas:
- Cada esterigma hincha en ápice → basidiospora madura
- Basidio maduro = 4 basidiosporas externamente adheridas
Cronología: 24-48h desde cariogamia hasta esporas maduras
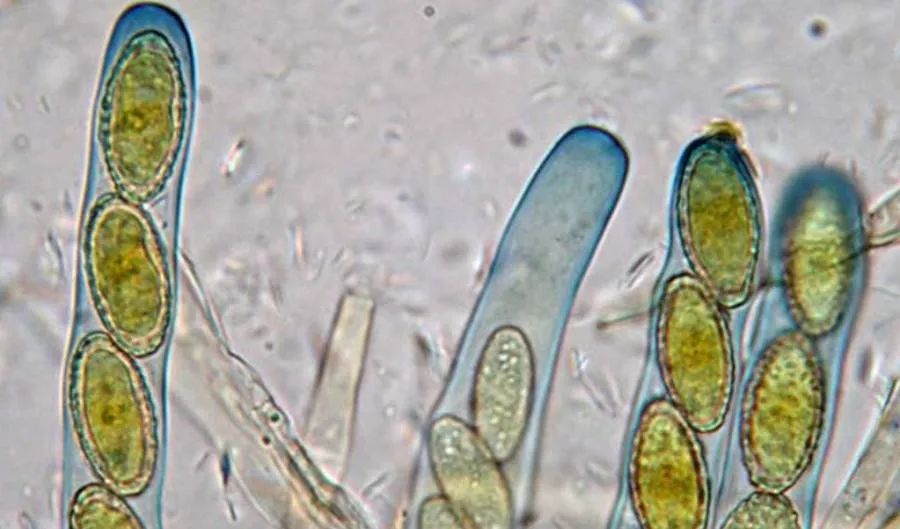
Ascosporas: formación interna
Estructura: Asco
Proceso:
- Fusión células compatibles → hifas dicarióticas
- Formación asco (célula especializada)
- Cariogamia + meiosis → 8 núcleos haploides (típicamente)
- Esporas se forman dentro del asco (endógenas)
- Liberación: Asco madura → presión interna → expulsión explosiva
Conidiosporas: asexual simple
Proceso:
- Hifa forma conidióforo (rama aérea especializada)
- Célula terminal del conidióforo sufre mitosis
- Nueva célula se separa → conidiospora
- Repetición rápida: Miles de conidios/día
Ventaja: Extremadamente rápido (horas vs días para sexual)
Mecanismos de liberación: ingeniería natural
1. Ballistospora (proyección activa)
Mecanismo de basidiosporas:
Descubrimiento: A. H. R. Buller (1909) documentó que basidiosporas son lanzadas activamente a ~0.1mm distancia del basidio
Proceso (Buller’s drop mechanism):
Formación gota de Buller:
- Condensación de agua en base de esterigma (hilum)
- Gota crece durante 1-2 minutos
Fusión súbita:
- Gota de Buller se fusiona con película de agua en superficie espora
- Coalescencia asimétrica → cambio centro de masa
Catapulta:
- Espora es lanzada (aceleración ~10,000 g, velocidad ~1 m/s)
- Distancia: 0.1-0.5mm (suficiente para escapar capa límite aire estancado)
Eficiencia: Este mecanismo permite que esporas caigan libremente sin adherirse a láminas/tubos del hongo
2. Explosión (ascosporas)
Mecanismo:
- Asco acumula presión osmótica (turgencia)
- Al madurar, opérculo (tapa) en ápice se rompe
- Esporas expulsadas a velocidades >100 km/h
- Distancia: 1-10cm (récord: >30cm en Ascobolus)
Aplicación ecológica: Asegura dispersión incluso sin viento
3. Puffing (soplido)
Mecanismo en puffballs:
- Cuerpo fructífero maduro = saco de esporas secas + polvo
- Impactos (gotas lluvia, animales, viento) comprimen cuerpo
- Nube de esporas expulsada por ostiolo (apertura)
Eficiencia: Una gota lluvia puede liberar 1 millón esporas
4. Pasivo (viento/contacto)
Mecanismo:
- Esporas secas (conidios) simplemente se desprenden
- Dispersión por corrientes de aire, toque físico
Ejemplos: Penicillium, Aspergillus (mohos comunes)
Dispersión: conquistando el planeta
Agentes de dispersión
| Agente | Mecanismo | Distancia típica | Ejemplos |
|---|---|---|---|
| Viento | Esporas <20µm permanecen suspendidas (aerosol) | 10-1,000+ km | Mayoría hongos, Puccinia (royas) |
| Agua | Esporas flotan o son arrastradas | Local (metros) a regional (ríos) | Hongos acuáticos, Phytophthora |
| Animales | Adhesión a pelaje/patas, ingesta | Variable (metros a km) | Trufas (mamíferos), Pilobolus (estiércol) |
| Insectos | Vectores específicos | Metros a km | Ophiocordyceps (zombie ants) |
| Humanos | Transporte accidental (ropa, vehículos) | Global | Batrachochytrium (quitridiomicosis) |
Adaptaciones para máxima dispersión
Tamaño reducido: <10µm → flotabilidad óptima (velocidad sedimentación <1 cm/s)
Ornamentación: Espinas, verrugas → aumentan superficie → mayor suspensión aérea
Hidrofobicidad: Superficie repele agua → no se aglutinan en lluvia
Pigmentación (melanina): Protección contra UV durante transporte aéreo
Producción masiva: Estrategia “quantity over quality” → al menos algunas llegan a hábitat apropiado
Germinación: de espora a micelio
Requisitos para germinación
| Factor | Requisito típico | Variación por especie |
|---|---|---|
| Humedad | >90% HR o agua libre | Algunas requieren inmersión total |
| Temperatura | 15-25°C | Termófilos: 40-50°C; Criofílicos: 0-10°C |
| Oxígeno | Aeróbico (O₂ necesario) | Algunos anaerobios facultativos |
| Nutrientes | Carbono simple (glucosa) + nitrógeno | Especies variadas (celulosa, lignina) |
| pH | 5.0-7.0 | Acidófilos: pH 2-4 |
| Luz | No esencial (mayoría) | Algunos requieren luz (fotomorfogénesis) |
Proceso de germinación
Fase 1: Activación (horas 0-6)
- Espora absorbe agua → hinchazón (~30% aumento volumen)
- Metabolismo “despierta” (síntesis ATP, proteínas)
- Pared espora se debilita enzimáticamente
Fase 2: Emergencia del tubo germinativo (horas 6-24)
- Pared espora se rompe en punto débil
- Tubo germinativo emerge (primera hifa)
- Crecimiento direccional (hacia nutrientes, luz dependiendo especie)
Fase 3: Establecimiento de micelio (días 1-7)
- Tubo germinativo ramifica → red de hifas
- Micelio explora sustrato
- Colonización activa comienza
Cronología total: 12 horas (rápidas, Aspergillus) a 7+ días (lentas, Ganoderma)
Latencia: estrategia de supervivencia
Latencia constitutiva: Esporas requieren período de “maduración” post-formación (semanas a meses) antes de poder germinar
Latencia exógena: Condiciones externas inhiben germinación (frío, sequía)
Ruptura de latencia:
- Choque térmico (calor o frío extremo)
- Químicos específicos (humo, compuestos volátiles)
- Paso por tracto digestivo animal (escarificación)
Resistencia extrema: esporas como fortalezas microscópicas
Mecanismos de resistencia
1. Deshidratación extrema:
- Contenido agua: 5-20% (vs 70-90% células vegetativas)
- Vitrifación: Citoplasma forma gel vítreo → metaboismo casi nulo
2. Pared celular multi-capa:
- Externa: Melanina (pigmento oscuro) → protección UV, deshidratación
- Media: Quitina + glucanos → resistencia mecánica
- Interna: Barrera selectiva
3. Acumulación de protectores:
- Trehalosa (azúcar): Estabiliza membranas/proteínas en ausencia de agua
- Proteínas protectoras (HSPs - Heat Shock Proteins)
4. Reparación DNA:
- Sistemas de reparación activos post-germinación
Resistencia documentada
| Condición extrema | Resistencia | Ejemplo |
|---|---|---|
| Calor | 100°C (hervir), varias horas | Bacillus (bacteria, comparable) |
| Frío | -200°C (nitrógeno líquido), años | Esporas hongos liquenizados |
| Radiación UV | 10x dosis letal humanos | Esporas pigmentadas (melanina) |
| Vacío espacial | Sobreviven exposición directa | Experimento ISS (Aspergillus) |
| Sequía | 0% humedad, décadas | Esporas museo (>100 años germinan) |
| Presión | 600 MPa (6,000 atmósferas) | Esporas hongos marinos profundos |
| Químicos | Alcohol 70%, hipoclorito moderado | Variable, clamidosporas más resistentes |
Récord longevidad: Esporas de hongos en ámbar (>40 millones años) se especula podrían germinar (no confirmado experimentalmente)
Aplicaciones prácticas
1. Cultivo de hongos
Inoculación con esporas vs micelio:
| Aspecto | Esporas | Micelio (spawn) |
|---|---|---|
| Velocidad colonización | Lenta (germinar primero) | Rápida |
| Costo | Muy bajo (millones esporas/jeringa) | Moderado |
| Contaminación | Alto riesgo (esporas competidores también presentes) | Bajo (micelio establecido domina) |
| Uso comercial | Raro (solo investigación/breeding) | Estándar |
| Diversidad genética | Alta (cada espora única) | Clon (idéntico) |
Huella esporada (spore print):
Técnica para obtener esporas puras:
- Colocar sombrero hongo maduro sobre papel (láminas hacia abajo)
- Cubrir con vaso (evitar corrientes aire)
- Esperar 6-24h
- Resultado: Millones esporas depositadas (patrón láminas visible)
- Uso: Inoculación medi agar, identificación especie
2. Identificación micológica
Color huella esporada = clave taxonómica:
| Color | Familias/Especies típicas |
|---|---|
| Blanco | Amanita, Pleurotus, Laccaria |
| Rosa-salmón | Entoloma, Pluteus |
| Marrón claro | Agrocybe, Pholiota |
| Marrón oscuro/chocolate | Agaricus (champiñón), Panaeolus |
| Negro-púrpura | Coprinus, Psathyrella |
| Amarillo-ocre | Boletus (algunos), Cortinarius |
Microscopía esporada:
Tamaño, forma, ornamentación → identificación especie exacta
3. Conservación de cepas
Criopreservación:
- Suspensión esporas en glicerol 10-15%
- Almacenamiento -80°C o nitrógeno líquido (-196°C)
- Viabilidad: Décadas a siglos
Almacenamiento seco:
- Esporas en papel filtro estéril, sellado con desecante
- Temperatura ambiente a 4°C
- Viabilidad: Años (variable por especie)
Rol ecológico de esporas
Dispersión global de nutrientes
Escenario:
- Hongo degrada madera en bosque A
- Esporas liberadas → transportadas 100km por viento
- Germinan en bosque B
- Resultado: Transferencia genética + recolonización
Impacto: Esporas son vectores de biodiversidad fúngica global
Inoculación micorrízica
Esporas de hongos micorrízicos:
- Transportadas a suelos desnudos (ej. post-incendio)
- Germinan → colonizan raíces plantas
- Resultado: Facilitación sucesión ecológica (plantas crecen mejor)
Enfermedades vegetales/animales
Patógenos fúngicos:
- Puccinia graminis (roya trigo): Esporas infectan cereales → pérdidas agrícolas masivas
- Batrachochytrium dendrobatidis (quitridiomicosis): Esporas acuáticas → colapso poblaciones anfibios
- Ophiocordyceps unilateralis (zombie ant): Esporas infectan hormigas → control comportamiento
Control: Entender dispersión/germinación esporas → estrategias prevención
Contaminación ambiental
Esporas como indicadores:
- Concentración esporas Aspergillus/Penicillium en aire interior → calidad ambiental
- Esporas patógenas (ej. Cryptococcus) → riesgos salud pública
Seguridad y salud
Alergias y asma
Esporas fúngicas = alérgenos comunes:
- Alternaria, Cladosporium, Aspergillus → rinitis alérgica, asma
- Mecanismo: Proteínas en pared espora → respuesta inmune
Población afectada: ~10-30% personas sensibles
Infecciones (micosis)
Inhalación esporas patógenas:
- Aspergillus fumigatus → aspergilosis (pulmones)
- Histoplasma capsulatum → histoplasmosis (pulmones, diseminada)
- Grupos de riesgo: Inmunodeprimidos (VIH, quimioterapia, trasplantes)
Intoxicación (micotoxinas)
Esporas de mohos toxigénicos:
- Stachybotrys chartarum (“black mold”) → tricotecenos (irritantes, inmunosupresores)
- Aspergillus flavus → aflatoxinas (carcinógenas)
Exposición: Inhalación esporas + micotoxinas en edificios húmedos dañados por agua
Curiosidades asombrosas
El sonido del lanzamiento de esporas:
Basidiosporas siendo lanzadas producen sonido ultrasónico (~4-6 kHz, inaudible humanos) detectable con micrófonos especiales.Esporas en estratosfera:
Esporas fúngicas han sido detectadas a 70km altitud (límite espacio), transportadas por corrientes atmosféricas.Pilobolus: el francotirador fúngico:
Hongo coprófi lo lanza esporangio completo a >2 metros con precisión dirigida hacia luz (aterriza en pasto → herbívoro come → ciclo completa).Esporas como núcleos de condensación:
Esporas fúngicas en atmósfera actúan como núcleos para formación de gotas lluvia/nieve (influyen clima).El hongo más grande del mundo es un micelio, pero comenzó como espora:
Armillaria ostoyae en Oregón (3.8 km², 2,400 años) → originó de una espora que germinó.
Conclusión: microscópicas pero omnipotentes
Las esporas representan la solución evolutiva del reino fungi para tres desafíos universales:
- Supervivencia en ambientes hostiles
- Dispersión a escala planetaria
- Reproducción masiva con mínimos recursos
Con tamaños medidos en micrómetros pero impactos planetarios, las esporas fúngicas:
- Reciclan ~85% materia orgánica terrestre (degradación bosques)
- Sostienen 90% plantas terrestres (micorrizas)
- Causan epidemias agrícolas (royas, tizones)
- Proveen antibióticos (Penicillium) y alimentos (levaduras)
Comprender las esporas es comprender cómo los hongos —segundo reino más diverso después de insectos— moldean nuestro planeta.
Referencias
Buller, A. H. R. (1909). Researches on Fungi (Vol. 1). Longmans, Green and Co.
Ingold, C. T. (1971). Fungal Spores: Their Liberation and Dispersal. Clarendon Press.
Pringle, A., et al. (2005). Spore dispersal and the evolution of the mushroom shape. PNAS, 102(24), 8575-8580.
Dressaire, E., et al. (2016). Mushroom spore dispersal by convectively created gust fronts. PNAS, 113(11), 2833-2838.
Última actualización: Diciembre 2024
¿Trabajas con esporas en cultivo o investigación? Comparte técnicas de huella esporada, criopreservación, o identificación microscópica en los comentarios.